NoninBio®基质胶使用指南
NoninBio®标准型基质胶,含酚红;
NoninBio®低生长因子基质胶 ,无酚红;
NoninBio®低生长因子基质胶 ,含酚红;
NoninBio®高浓度基质胶,无酚红;
NoninBio®高浓度基质胶,含酚红;
NoninBio®类器官专用基质胶 ,无酚红;
NoninBio®干细胞专用基质胶 ,无酚红;
品牌:NoninBio
NoninBio®基质胶使用指南
Part I 基质胶——常识篇
1 、基质胶分类?
基质胶主要分为 5 大类(表 1),分别为标准型(Standard, STD)、细胞因子减少型(Growth Factor Reduced, GFR) 、高浓度型(High Concentration, HC) 、类器官专用型(Organoid)和干细胞专用 型(Embryonic Stem Cell, ESC)。
2 、应该采购哪一款的基质胶?
2. 1 标准型基质胶适用于适用于极化细胞的培养,如上皮细胞。促进多种类型细胞的分化, 包括肝细胞、神经元、β-胰岛细胞、乳腺上皮细胞、内皮细胞和平滑肌细胞。例如侵袭实验、 成管实验等。
2.2 细胞因子减少型基质胶适用要求基质胶成分相对明确的实验,例如类器官培养、血管生 成、干细胞培养等。
2.3 高浓度型基质胶适用于体内成瘤(CDX 、PDX)和体内血管生成(Plug Assay)等。高浓度基 质胶成胶速度快,凝胶刚性高,具有更好的支架效果(Cell Scaffold)。
2.4 类器官专用型基质胶属于细胞因子减少型亚类,有较高浓度和刚性,且通过小鼠小肠类 器官培养测试,能再现小肠类器官出芽表型和分子标志物表达特征。
2.5 胚胎干细胞专用型基质胶是经验证具有特定培养基兼容性,且稳定维持干细胞形状和干 性的基质胶。
表 1 基质胶分类和应用场景
标准型 Standard | 生长因子减少 | 高浓度 HC | 类 器 官 专 用 Organoid | 干 细 胞 专 用 Stem cell | |
应 用 场 景 | 适用于极化细胞的培养, | 适用需要成分相明确的基底 | 高浓度基质胶凝胶 后具有更高的刚度 和支架完整性。适 合体内细胞运输应 用,可改善细胞植 入效果并促进实体 瘤形成。 | 精选适合类器官培 养基质胶(浓度、刚度)。 | 经验证具有特定培养 |
来 源 | 小鼠肉瘤 | ||||
蛋白浓度 | 8-12 mg/ml | 8-12 mg/ml | 16-22 mg/ml | 8-12 mg/ml | 8-12 mg/ml |
保 质 期 | 从生产时期计时,2年 | ||||
货 号 | NBJ6234-5ml(含酚红) NBJ6234-10ml(含酚红) NBJ6237-5ml(无酚红) NBJ6237-10ml(无酚红) | NBJ6230-5ml(含酚红) NBJ6230-10ml(含酚红) NBJ6231-5ml(无酚红) NBJ6231-10ml(无酚红) | NBJ4248-5ml(含酚红) NBJ4248-10ml(含酚红) NBJ4262-5ml(无酚红) NBJ4262-10ml(无酚红) | NBJ6255-5ml(无酚红) NBJ6255-10ml(无酚红) | NBJ4277-5ml(无酚红) NBJ4277-10ml(无酚红) |
NoninBio®基质胶产品列表
| 大类 | 亚类 | 货号 | 规格 | 目录价 | 对标康宁货号 |
| NoninBio®标准型基质胶 | 无酚红 | NBJ6237 | 5 ml | 1530 | 康宁不含酚红的标准型基质胶没有5ml规格 |
| 10 ml | 2720 | 356237 | |||
| 含酚红 | NBJ6234 | 5 ml | 1530 | 356234 | |
| 10 ml | 2720 | 354234 | |||
| NoninBio®低生长因子基质胶 | 无酚红 | NBJ6231 | 5 ml | 1870 | 康宁不含酚红的低生长因子基质胶没有5ml规格 |
| 10 ml | 3485 | 356231 | |||
| 含酚红 | NBJ6230 | 5 ml | 1870 | 356230 | |
| 10 ml | 3485 | 354230 | |||
| NoninBio®高浓度基质胶 | 无酚红 | NBJ4262 | 5 ml | 2720 | 康宁不含酚红的高浓度基质胶没有5ml规格 |
| 10 ml | 5270 | 354262 | |||
| 含酚红 | NBJ4248 | 5 ml | 2720 | 康宁含酚红的高浓度基质胶没有5ml规格 | |
| 10 ml | 5270 | 354248 | |||
| NoninBio®类器官专用基质胶 | 无酚红 | NBJ6255 | 5 ml | 2125 | 康宁类器官专用基质胶没有5ml规格 |
| 10 ml | 3910 | 356255 | |||
| NoninBio®干细胞专用基质胶 | 无酚红 | NBJ4277 | 5 ml | 1955 | 354277 |
| 10 ml | 3570 | 康宁干细胞专用基质胶没有10ml规格,因为酚红有点雌激素,所以我们的干细胞专用基质胶没有加酚红 |
3 、基质胶保存、解冻、运输和分装?
保存:基质胶通常保存于-20 ℃的无除霜功能冰箱;
解冻:将基质胶包装瓶埋于碎冰中(仅暴露瓶口),置于 2-8℃冰箱过夜;
运输:干冰物流运输;
分装:结合每轮实验基质胶使用量进行分装,分装后于-20 ℃的无除霜功能冰箱保存,避免 反复冻融。
4 、使用基质胶前需要试剂和耗材预冷吗?
由于基质胶在高于 8 ℃的环境温度下就会以不可逆形式聚合形成凝胶,所以在操作基质胶过 程中,试剂(培养液、稀释液、细胞悬液等)和耗材(吸头、培养皿、EP 管和管架等)都 要求预冷,冰上操作。
5 、基质胶颜色和状态?
冻存状态下,含酚红基质胶颜色通常为浅橘红色,不含酚红基质胶呈现碎冰样白色;解冻后, 含酚红基质胶紫红色。解冻后不含酚红高浓度基质胶为半透明浓稠浊液,低浓度基质胶为近 乎透明状液体。
6、基质胶出现沉淀怎么办?
如发现基质胶存在少量沉淀,建议 4 ℃低速离心后使用(5000 rpm for 5 min),通常不影响基 质胶活性。
7、包被培养皿时,基质胶使用量?
表 2 基质胶包被培养皿用量指导
薄胶 Thin Gel | 厚胶 Thick Gel |
50 ul/cm2 | 150-200 ul/cm2 |
培养皿 Culture ware | 生长面积 Growth area(cm2) |
6-well plate | 9.6 |
24-well plate | 2.0 |
96-well plate | 0.32 |
35 mm x 10 mm dish | 11.78 |
100 mm x 20 mm dish | 58.95 |
Part II 基质胶——实操篇
1 、内皮细胞血管生成实验(Tube Formation Assay)
1.1 实验目的
血管形成实验是体外研究血管生成的经典方法,该方法可快速确定调控血管生成的基因、 小分子或信号通路,结合钙黄绿素(Calcein)染色和 Image J 分析工具,可以实现血管生成的 定量分析。
1.2 实验步骤
1.2. 1 包被:基质胶解冻后,按照每孔 50-60 μl 的量加入预冷 96 孔板培养孔中(尽量避 免基质胶产生气泡) ,并轻轻摇晃培养板,使基质胶均匀铺于培养孔孔底;然后置于 37 ℃细 胞培养箱聚合 30 min。
1.2.2 细胞制备:将对数生长期培养中的 HUVEC 细胞消化,制备成 2E+5 cell/ml 悬液(计 数一定要准确)。
1.2.3 接种:细胞混匀计数后,将细胞接种至已报备培养孔中,每孔 100 μl ,轻轻摇匀 后,置于 37 ℃细胞培养箱继续培养。
1.2.4 观察:培养 6 h(或其他指定时间点)后,显微镜下观察成管情况,同时采集照片。
1.3 注意事项
1.4.1 血管内皮细胞成管实验推荐使用标准型(货号: NBJ6234)或细胞因子减少型(货 号:NBJ6230)基质胶,胶浓度为 8-10 mg/ml 最佳。
1.4.2 体外血管形成实验除了选好合适的基质胶之外, 内皮细胞的状态也极为关键,建 议选择 3-5 代次的细胞进行实验,铺板接种前注意细胞状态(对数生长期)并进行饥饿培养。 同时细胞接种数量不能过稀或者过密。
1.4 结果示例
2 、侵袭实验(Invasion)
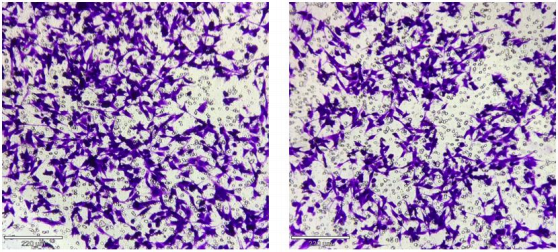
2.1 实验目的
细胞侵袭实验是体外模拟细胞主动突破物理屏障发生位置转移能力的一种实验技术,被 广泛应用于各种细胞侵袭转移能力探索研究中,结合结晶紫染色可实现定量分析。应用于炎 症反应、癌症转移、胚胎发育、血管生成、伤口愈合、免疫反应、动脉粥样硬化等研究领域。
2.2 实验步骤
2.2. 1 基质胶稀释:基质胶解冻后,将基质胶用无血清培养基稀释至 1 mg/ml 左右,混匀后 冰置于上备用。
2.2.2 小室铺胶:按照每小室 60 μl 的量将稀释后的基质胶垂直加入预冷小室底部,不要产生 气泡,然后置于 37℃细胞培养箱孵育 2-3 h ,使基质胶充分聚合为薄膜层。
2.2.3 基底膜水化:孵育后将小室中多余液体小心吸掉,加入 100 ul 无血清培养基,然后置 于 37℃细胞培养箱孵育 30 min ,使基底膜充分水化。
2.2.4 检漏:小心吸出小室中液体,检查是否有液体穿过小室进入下室中,若漏液则可用于 下游细胞接种(选做,非必须)。
2.2.5 细胞制备:消化对数生长期待检测细胞,清洗后细胞重悬计数,将细胞浓度调整至 1-10e+5 cell/ml(根据待测细胞的迁移能力强弱调整细胞密度);在 24 孔板下室加入 600 μl 含 5%-10% FBS 或趋化因子的培养基,然后用镊子将 Transwell 小室置于 24 孔板内,取适量 细胞悬液(100-200 μL)加入上室,最后置于培养箱中培养 12-48 h(细胞量和时间视细胞侵袭 能力变化,结合预实验确定);同时设置对照孔,下室添加等体积无血清培养基。
2.2.6 固定:在指定时间点,取出 Transwell 小室,去除培养液,用 PBS 浸湿的棉签或棉花轻 轻擦拭小室内基质胶和细胞。在 24 孔板干净的孔中加入 600 µl 4%多聚甲醛固定液,将小室 放入固定 30 分钟。然后弃固定液,PBS 洗涤小室内外 1 次。
2.2.7 结晶紫染色:在 24 孔板干净的孔中加入 600 uL 结晶紫染色液,将小室放入染色 10 分 钟。
2.2.8 取出小室,PBS 洗涤小室内外 3 次。适当风干后,显微镜下观察定性研究;取 3-5 个 视野拍照。
2.2.9 定量分析:用 Image J 计数取平均值进行定量研究。
2.3 注意事项
2.3. 1 根据细胞大小选择合适的 Transwell chamber 小室,常用的为 8 μm 孔径,细胞培养板 有 6- ,12-和 24-孔板等,最常用的是 24 孔板。
2.3.2 接种细胞状态和密度非常关键,需结合预实验确定接种数量以及后续检测固定染色时 间点。
2.4 结果示例
3 、皮下成瘤(Xenograft)
3.1 实验目的
皮下成瘤实验为肿瘤发生发展研究和肿瘤药物开发奠定了疾病模型基础,被广发应用于各种 肿瘤发病机制研究。高浓度基质胶有效促进肿瘤形成,为肿瘤细胞提供合适的生长微环境。
3.2 实验步骤
3.2. 1 选取对数生长期的细胞,细胞汇合度达 80-90%左右为宜;
3.2.2 消化细胞后用预冷的 PBS 洗两遍, 目的为去除细胞中残余的血清和胰酶。
3.2.3 细胞用预冷 PBS 或无血清培养重悬,计数并根据需求调整细胞密度。细胞悬液与高浓 度基质胶 1:1 混匀(如果细胞成瘤能力较高,基质胶终浓度可以降低)。一般皮下瘤接种的 细胞量为 1-5×10^6 个细胞/鼠,接种体积为 0.1-0.2 ml。
3.2.4 裸鼠周龄 4-6 周龄,体重 16-18 g 左右,种植部位选择血供丰富区域,如腋下中后部;
3.2.5 从进针部位向前穿刺大约 1 cm ,进行皮下注射,针头在皮下左右滑动几次,以便细胞 接种成团,避免注射后细胞悬液从针眼溢出;
3.2.6 接种后正常饲养,4-6 周成瘤,过程中检测小鼠体重,肿瘤体积变化;最后取瘤进行 拍照成像,保存组织用于下游实验检测。
3.3 注意事项
3.3. 1 细胞与基质胶混匀后,需置于冰上放置,并尽快注射,避免基质胶聚合;同时低温能 降低细胞代谢,维持细胞活力。
3.3.2 不同细胞成瘤能力也不同,所以细胞接种数量需结合预实验确定最佳值。
3.3.3 稀释后的基质胶浓度不可低于 4 mg/ml。
3.4 结果示例
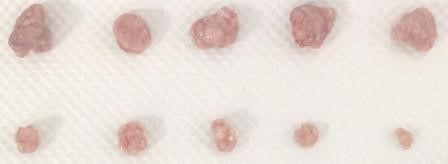
注:上排为加基质胶组,下排为 PBS 对照组
4 基质胶塞实验(Matrigel Plug Assay)
4.1 实验目的
基质胶塞实验是体内探究血管生成的一种技术,可用于分析调控血管生成的基因、小分 子或者信号通路,结合病理染色实验能实现血管生成的定性和定量检测。
4.2 实验步骤
4.2. 1 从-20℃或-80℃冰箱取出高浓度基质胶,将其埋于碎冰之中,置于 4 ℃冰箱过夜 解冻。
4.2.2 将 EP 管、注射器、针头、吸管等置于 4℃或冰上预冷,避免后续基质胶操作过程 中提前聚合凝胶。
4.2.3 将 500 ul 高浓度基质胶转移至 1.5 ml EP 管中,并添加待测药品(小分子化合物和 蛋白等),充分混匀后置于冰上。
4.2.4 麻醉小鼠(注射阿佛丁或其他吸入式麻醉)。麻醉后剃毛刀剃出小鼠身体一侧待 注射位置毛发,酒精棉擦拭消毒备用。
4.2.5 在备皮处进行皮下注射,注射时速度切记不要太快,慢慢推进给药;注射后 7-15d 形成基质胶塞,并血管化。
4.2.6 血管生成实验结束后,麻醉处死小鼠,取出基质胶塞,置于 DMEM 中,去除基 质胶塞表面粘附的其他组织,然后于 PBS 中再次清洗。
4.2.7 图像采集与样本保存:清洗干净后拍照保存,胶塞的红色程度代表血管生成的水 平;样本保存后,可以用于病理染色分析血管形成的组织形态。
4.3 结果示例

Akhtar N, Dickerson EB, Auerbach R. The sponge/Matrigel angiogenesis assay[J]. Angiogenesis, 2002, 5: 75-80.
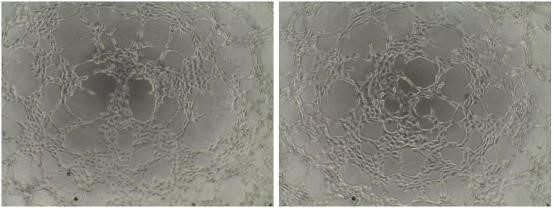
5 、类器官培养(Organoids)
5.1 实验目的
利用临床来源生物标本的祖细胞或者干细胞株(例如 iPS ,ADSC 等), 以基质胶作为 三维立体培养支架(Scaffold),在特定细胞因子作用下,体外诱导生成的类组织微球并定义为 类器官(Organoids)。其细胞分序组织结构、遗传物质稳定性以及药物反应性与供体基本一致, 在新药研发、精准医学、再生医学、基础科研等领域具有重要的应用价值和前景。
5.2 实验步骤
5.2. 1 解冻:从-20℃或-80℃冰箱取出基质胶,将其埋于碎冰之中(瓶扣朝上),并将冰盒置 于 4 ℃冰箱过夜解冻。
5.2.2 分装:解冻后,轻轻摇匀基质胶,并结合每次实验基质胶需求量,分装基质胶,保留
1 管即用,其他的分装后立即转移至-20 ℃无除霜功能冰箱冻存(注:尽量放置到冰箱最深 处,避免冰箱门附近放置)。
5.2.3 细胞制备:组织样本消化、制备单细胞悬液以及计数(略)。
5.2.4 穹顶制备:将细胞沉淀(冰上预冷)用基质胶重悬并混匀(胶:细胞悬液比值大于等 于 1.5),进行点胶(Dome),点胶完成后,将培养板倒扣转移至培养箱,37 ℃孵育 15-30 min; 然后添加适量已预热的完全培养基(缓慢轻柔),置于 37 ℃ , 5% CO2 培养箱中孵育培养, 每天观察类器官生长情况,结合类器官数量等安排换液(换液时培养基提前预热)、传代或 者冻存。
5.3 结果示例
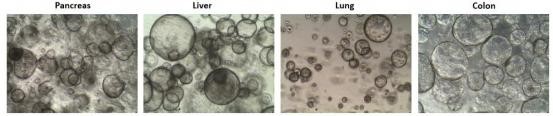
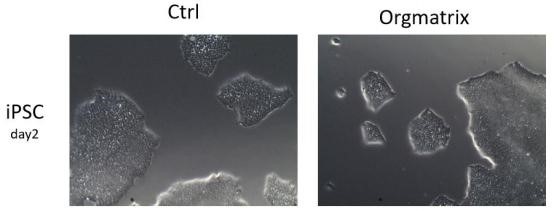
6 、干细胞培养(Stem cell)
6.1 实验目的
干细胞(Stem cell)是一类具有自我更新和分化潜能的细胞,例如 iPSC ,ESC 等。通 常干细胞培养时需要血清和/或胚胎成纤维细胞饲养层的加持,但是该方法后续筛选工作耗 时,且实验再现性和一致性相对较差。基质胶作为干细胞培养包被基质,一定程度上降低了 干细胞培养的繁琐性,同时实验结果具有更好的再现性和一致性。
6.2 实验步骤(以 iPSC 为例)
6.2. 1 解冻:从-20 ℃或-80℃冰箱取出基质胶,将其埋于碎冰之中(瓶扣朝上),并将冰盒置 于 4 ℃冰箱过夜解冻。
6.2.2 分装:解冻后,轻轻摇匀基质胶,并结合每次实验基质胶需求量,分装基质胶,保留
1 管即用,其他的分装后立即转移至-20 ℃无除霜功能冰箱冻存(注:尽量放置到冰箱最深 处,避免冰箱门附近放置)。
6.2.3 稀释:将基质胶按照预定比例用预冷 DMEM/F12 稀释(具体稀释比例需结合基质胶浓 度和预实验确定,通常稀释倍数在 50-100 之间)。
6.2.4 包被:将稀释后的基质加入 6 孔培养板(1 mL/孔)或 100 mm 培养皿(8 mL/培养皿) 。在 使用前请将培养皿在室温下(37 ℃)孵育 2 小时,待基质胶聚合后,使用前小心吸出培养皿中 剩余的液体,尽量避免刮擦培养表面。
6.2.5 接种:将制备好的 iPSC 细胞悬液接种到包被后的培养板或培养皿中,轻轻摇匀细胞, 于 37 ℃ , 5% CO2 培养箱中孵育培养,每天观察细胞状态并每天更换培养基。
6.3 结果示例